原标题:【团标Word】伤口敷料的标准 || 一次性使用无菌医用敷贴-T/CSBME 010-2019
作者:感染管理2021


前言
本标准按照GB/T 1.1-2009给出的规则起草。
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。
本标准由中国生物医学工程学会提出。
本标准由中国生物医学工程学会医疗器械标准工作委员会归口。
本标准起草单位:河南省医疗器械检验所、河南驼人医疗器械研究院有限公司、河南亚都实业有限公司、新乡市华西卫材有限公司、河南驼人贝斯特医疗器械有限公司。
本标准主要起草人:周静、崔景强、段书霞、王瑞平、李风光、张正男、王方园、崔文波、孟星
引言
近年来,随着国民经济的飞速发展,医疗需求多样性逐日增加,催生了大量医疗器械生产企业,以一次性无菌医用敷贴为例,境内已注册上市的企业有数百家之多,产品注册证逾300 个。
目前,医用敷贴尚无专用产品标准,仅有部分原材料标准,如YY/T 0148-2006《医用胶带通用要求》,FZ/T 64005-2011《卫生用薄型非织造布》等,产品标准的缺失不利于无菌医用敷贴类产品的质量控制与监管,亦不利于医用敷贴行业的有序健康发展。
本标准以现有认知为基础,对一次性无菌医用敷贴相关性能予以规定,供相关研发、生产、检验、质量管理等单位和部门参考。
鉴于科学技术的不断提高,医用敷贴类产品也在不断创新发展,对产品的性能控制与安全性研究仍需要长期深入的积累,需予以进一步关注和完善。
1范围
本标准规定了一次性使用无菌医用敷贴(以下简称敷贴)结构组成、技术要求、试验方法、标志、包装、运输和贮存。
本标准主要适用于由涂胶基材、吸收性敷芯和可剥离的隔离纸组成为主要结构特征的医用敷贴,产品临床适用于用于非慢性创面(如浅表性创面、手术后缝合创面、机械创伤、小创口、擦伤、切割伤创面、穿刺器械的穿刺部位、I度或浅II度的烧烫伤创面、婴儿肚脐口创口、激光/光子/果酸换肤/微整形术后创面)的护理,为创面愈合提供微环境。也可用于对穿刺器械(如导管)的穿刺部位的护理并固定穿刺器械。
本标准不适用于含有抗菌成分(如银、壳聚糖等)的敷贴。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191—2008 包装储运图示标志
GB/T 14233.1—2008 医用输液、输血、注射器具检验方法第1 部分:化学分析方法
GB/T 14233.2—2005 医用输液、输血、注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1 医疗器械生物学评价第1 部分:风险管理过程中的评价与试验
GB/T 16886.5 医疗器械生物学评价第5 部分:体外细胞毒性试验
GB/T 16886.10 医疗器械生物学评价第10 部分:刺激与皮肤致敏试验
GB/T 16886.12 医疗器械生物学评价第12 部分:样品制备与参照材料
GB/T 19633.1 最终灭菌医疗器械包装第1 部分:材料、无菌屏障系统和包装系统的要求
YY/T 0148—2006 医用胶带通用要求
YY/T 0313—2014 医用高分子产品包装和制造商提供信息的要求
YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1 部分:通用要求
YY/T 0471.1—2004 接触性创面敷料试验方法第1 部分:液体吸收性
YY/T 0471.2—2004 接触性创面敷料试验方法第2 部分:透气膜敷料的水蒸气透过率
YY/T 0471.3—2004 接触性创面敷料试验方法第3 部分:阻水性
YY/T 0471.4—2004 接触性创面敷料试验方法第4 部分:舒适性
YY/T 0471.5—2017 接触性创面敷料试验方法第5 部分:阻菌性
YY/T 0615.1 标示“无菌”医疗器械的要求第1 部分:最终灭菌医疗器械的要求
YY/T 1627—2018 急性创面用敷贴、创贴通用要求
3材料及结构组成
3.1型号规格
3.1.1敷贴根据基材的不同分为:无纺布型、纸框透明型;
3.1.2敷贴规格以基材的基本尺寸不同进行划分,基本尺寸以“长×宽”表示,单位为厘米。
3.2结构组成
3.2.1敷贴由基材、敷芯(有或无)、隔离纸组成;
3.2.2敷贴的结构示意图详见图1:
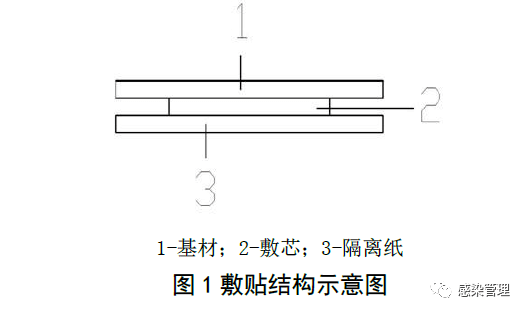
3.3材料
3.3.1 基材材料
3.3.1.1 无纺布型敷贴基材一般采用喷涂医用压敏胶的无纺布制成;
3.3.1.2 纸框透明型敷贴基材一般采用喷涂医用压敏胶的聚氨酯薄膜制成或其他适合的材料制成。
3.3.2 敷芯材料
敷贴敷芯一般由网膜和针刺棉制成。其中,网膜一般由聚乙烯(PE)和尼龙组成,针刺棉一般由粘胶和涤纶组成或其他适合的材料制成;
3.3.3 隔离纸材料
隔离纸一般采用格拉辛纸或聚对苯二甲酸乙二酯(PET)膜制成或其他适合的材料制成。
4术语和定义
4.1敷贴
由能适应各种不同粘贴部位的不同形状的胶贴层,与之连为一体的敷芯和可剥离的离型层组成。
敷芯主要为各种片状的吸收材料,有的吸收垫具有一层网膜或类似的材料以防止与创面粘连。为创面提供机械屏障,吸收创面渗出液。通常用于手术、外伤创面或留置动、静脉导管贴敷用,也可用于婴儿脐带创面保护的敷贴类产品。
[YY/T1627-2018,定义3.2,修改适用范围内容]
5技术要求
5.1外观
敷贴应色泽均匀,清洁、平整,无毛边、破损等现象。
5.2尺寸
5.2.1 无纺布型敷贴的尺寸
敷贴标称尺寸小于10cm,允差±10%,取绝对值较大者;标称尺寸大于等于10cm,允差±5%。
注:每块敷贴上面基材和隔离纸的尺寸应保持一致。
5.2.2 纸框透明型敷贴的尺寸
敷贴标称尺寸小于10cm,允差±10%或±2mm,取绝对值较大者;标称尺寸大于等于10cm,允差±5%。
注:每块敷贴上面基材和敷芯的尺寸应保持一致。
5.3剥离强度
粘贴部分每1cm 宽度所需的平均力应不小于1.0N。
注:对于应用场合对粘贴强度要求不高的敷贴,该指标可不小于0.5N,但需予以明示。
5.4持粘性
敷贴在烘箱内试验期间,贴于不锈钢板上粘贴胶带的顶端下滑应不超过2.5mm。
5.5阻水性(若声称具有“阻水”或“防水”)
敷贴应能承受500mm 静水压300S。
5.6舒适性(若声称具有“舒适”)
敷贴可伸展性应不大于2N/cm,永久变形应不大于5%。
5.7阻菌性(若声称“阻菌”)
敷贴应具有良好的阻菌性。
5.8水蒸气透过率(若声称“透气”)
敷贴每24h 的水蒸气渗透率应不少于500g/m2。
5.9液体吸收性
敷芯对于液体的吸收性应大于10g/100cm2
5.10酸碱度
敷芯的pH 值应在5.0~8.0 之间。
5.11水中溶出物
按照附录A 中A.1 规定的方法进行试验时,水中溶出物应不大于0.7%。
5.12表面活性物质
按照附录B 中B.1 规定的方法进行试验时,300s后供试液表面活性物质泡沫应不覆盖整个液体表面。
5.13环氧乙烷残留量
若采用环氧乙烷灭菌,环氧乙烷残留量应不大于10μg/g。
5.14无菌
经过一个确认过的灭菌过程灭菌,敷贴应无菌。
5.15生物相容性
经评价,结果应表明无不可接受的生物学危害。
6试验方法
6.1外观
在自然光下,用正常或矫正视力目测,结果应符合5.1 的规定。
6.2尺寸
用通用量具测量,结果应相应符合5.2.1、5.2.2 的规定。
6.3剥离强度
按照YY/T 0148—2006 中附录B.3 规定的试验方法进行试验时,结果应符合5.3 的规定。
注:6.3~6.13 试验时,对于尺寸/克重/面积达不到试验要求的产品宜使用取原材料进行试验。其中,6.3~6.9试验时,应在敷贴不包含敷芯的胶贴边进行。
6.4持粘性
按照YY/T 0148—2006 中附录B.2 规定的方法进行试验时,结果应符合5.4 的规定。
6.5阻水性
按照YY/T 0471.3—2004 中第3 章规定的方法进行试验时,结果应符合5.5 的规定。
6.6舒适性
按照YY/T 0471.4—2004 中第3 章规定的方法进行试验时,结果应符合5.6 的规定。
6.7阻菌性
按照YY/T 0471.5—2017 中第3 章规定的方法进行试验时,结果应符合5.7 的规定。
6.8水蒸气透过率
按照YY/T 0148—2006 中附录C 规定的方法进行试验时,结果应符合5.8 的规定。
6.9液体吸收性
按照YY/T 0471.1—2004 中第3 章规定的方法进行试验时,结果应符合5.9 的规定。
6.10酸碱度
试验液制备:称取0.1g 敷贴样品,将其放入25mL烧杯中。然后加入10mL 蒸馏水,混合均匀。将烧杯放入25℃的水中持续30 分钟。轻轻倒出液体,用玻璃棒挤压样品残存的液体并混入已倒出的液体中。用酸度计检测试验液,结果应符合5.10 的规定。
6.11水中溶出物
按照附录A 中A.1 规定的方法进行试验时,结果应符合5.11 的规定。
6.12表面活性物质
按照附录B 中B.1 规定的方法进行试验时,结果应符合5.12 的规定。
6.13环氧乙烷残留量
按照GB/T14233.1—2008 中第9 章规定的方法进行试验时,结果应符合5.13 的规定。
6.14无菌
按照YY/T 0615.1中4.2 的规定进行确认,结果应符合5.14 的规定。
6.15生物相容性试验
按照GB/T16886.1 中所述的生物学方法进行评价进行,应符合5.15 的规定。
7标志、包装、运输和贮存
7.1标志
7.1.1 单包装
单包装上至少应至少标有下列信息:
a) 制造商名称、地址、商标、电话;
b) 产品名称、型号规格;
c) 生产批号或生产日期、失效年月;
d) 产品注册证编号、生产许可证编号、产品技术要求编号/注册产品标准编号;
e)“一次性使用”、“无菌”、“包装破损,禁止使用”、“用后销毁”等字样或图形符号应符合YY/T 0466.1-2016 的规定。
7.1.2 货架或多单元包装
货架或多单元包装(若使用)应至少标有下列信息:
a) 制造商名称、地址、商标、电话;
b) 产品名称、规格型号、数量;
c) 生产批号或生产日期、失效年月(日期);
d) 产品注册证号、生产企业许可证、执行标准号;
e) 体积、数量;
f)“一次性使用”、“无菌”、“包装破损,禁止使用”、“用后销毁”等字样或图形符号应符合YY/T 0466.1-2016 的规定;
g)“怕晒”、“怕雨”等字样或符号应符合GB/T191—2008 的要求”。
7.2包装
7.2.1 包装应符合GB/T 19633.1的要求;
7.2.2 单包装设计应便于内装物无菌取用,包装打开后应留有打开过的痕迹;
7.2.3 若采用环氧乙烷灭菌时,初包装应采用一面具有透气功能的材料包装(如透析纸)。
7.3 运输
敷贴为非危险产品,在运输时应注意干燥,保持清洁,避免日晒雨淋,搬运时小心轻放,避免包装袋破裂、损伤。
7.4贮存
敷贴应贮存在清洁、干燥、通风的库房内,不得接触热源和有机溶剂,防止日晒和受潮。
附录A(规范性附录)水中溶出物试验
A.1.步骤 A.1.1 取1.00g 敷芯,放入100mL 的符合GB/T6682 的三级蒸馏水或去离子水中,煮沸30min,不时搅动并补充蒸发损失的水量A.1.2 小心倒出液体,用玻璃棒挤压样品中的残存液体并混入已倒出的液体中,趁热过滤。 A.1.3 取50mL 滤液蒸发(对应于1/2 样品的质量),在100℃-105℃下干燥至恒重。 A.2 结果表示 计算水中溶出物的量,以残留物所占实际样品质量的百分数表示。
附录B(规范性附录)表面活性物质试验
B.1 步骤 B.1.1 取去掉隔离层纸的敷贴适量放入适宜的容器中,按照1g 样品加入10mL 水的比例加水,置于密闭容器浸泡2h。 B.1.2 轻轻倒出液体,用玻璃棒挤压样品中的残存液体并混人已倒出的液体中,得试验液; B.1.3 取外径20mm 士2mm、带磨砂玻璃塞的量筒,用硫酸冲洗后,再用水冲洗,然后加入10mL 试验液在10s 内用力振摇30 次,然后放置1min,重复振摇,静止5min 后观察液体表面泡沫。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)返回搜狐,查看更多
责任编辑:
 公告:九九网站目录为广大站长提供免费收录网站服务,会员可在线完成投稿无需添加友情链接。
公告:九九网站目录为广大站长提供免费收录网站服务,会员可在线完成投稿无需添加友情链接。





